第87節
如果出现文字缺失,格式混乱请取消转码/退出阅读模式
一個水分子通常是被描述為由兩個氫原子和一個氧原子所構成(h2o)。如果所有的水分子都是如此,那它就會是低沸點的小分子。硫化氫(h2s)具有相似的但較重的分子(因為硫重於氧),它是一種氣體,只要在-61。8℃時就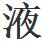 化。
化。
如果水只是h2o,那麼它就會在更低的溫度下,也許在-80℃左右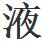 化。
化。
但是,可以看一看水分子的形狀。三個原子構成的圖形很接近於直角,而氧原子在頂點。氧與每一個氫原子共享兩個電子,但這種共享不是平均的。氧對於電子具有較強的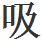 引力,因此,帶負電荷的電子偏向於水分子中氧的那一方。這就意味著,雖然水分子整個來說是不帶電的,但是水分子中氧的那一方有小量的負電荷,而兩個氫原子則有小量與它平衡的正電荷。
引力,因此,帶負電荷的電子偏向於水分子中氧的那一方。這就意味著,雖然水分子整個來說是不帶電的,但是水分子中氧的那一方有小量的負電荷,而兩個氫原子則有小量與它平衡的正電荷。
相反的電荷互相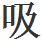 引。於是兩個鄰近的水分子有排列起來的傾向,而使一個水分子的負氧端接近於下一個水分子的正氫端,這就構成了一個“氫鍵”它的強度只是把分子中氫和氧保持在一起的普通鍵的二十分之一。這仍然足以使水分子有“粘
引。於是兩個鄰近的水分子有排列起來的傾向,而使一個水分子的負氧端接近於下一個水分子的正氫端,這就構成了一個“氫鍵”它的強度只是把分子中氫和氧保持在一起的普通鍵的二十分之一。這仍然足以使水分子有“粘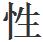 ”由於這種粘
”由於這種粘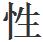 ,水分子比沒有粘
,水分子比沒有粘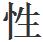 時容易結合在一起,更難以分開來。為了克服這種粘
時容易結合在一起,更難以分開來。為了克服這種粘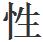 ,並使之煮沸,必須把水加熱到100℃。如果溫度下降到0℃,氫鍵的優勢就是鎖定水分子的位置並使之凍結為冰。如果不是因為有氫鍵的話,要凍結成冰,溫度就要比這還要低得多。
,並使之煮沸,必須把水加熱到100℃。如果溫度下降到0℃,氫鍵的優勢就是鎖定水分子的位置並使之凍結為冰。如果不是因為有氫鍵的話,要凍結成冰,溫度就要比這還要低得多。
對於像h2s(硫化氫)這樣的一些分子,就不會發生這種情況,因為硫原子和氫原子對於電子具有大致相同的引力。
在一方或者另一方都沒有電荷累積,因此沒有“粘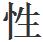 ”其次,假定在非常受限制的處所——例如在一個極其細小的玻璃管中存在著水分子。那麼,這些水分子便可能自行擠成比通常更密集。一個分子的氧原子可能被迫異常近地靠近相鄰分子的氫原子,以致氫鍵變得像普通的鍵一樣強。這時兩個分子變成了一個分子。另一個分子也許會鎖定在這個雙分子上,然後再鎖定一個,接著又鎖定一個。
”其次,假定在非常受限制的處所——例如在一個極其細小的玻璃管中存在著水分子。那麼,這些水分子便可能自行擠成比通常更密集。一個分子的氧原子可能被迫異常近地靠近相鄰分子的氫原子,以致氫鍵變得像普通的鍵一樣強。這時兩個分子變成了一個分子。另一個分子也許會鎖定在這個雙分子上,然後再鎖定一個,接著又鎖定一個。
結果可能有許多分子緊密地聚集在一起,將所有的氫和氧形成規則的六角形排列。所產生的複合物質是“聚合物”的一個例子。這就是“聚水”要把這樣一種物質(首先是1965年由蘇聯化學家報道的)分解為水蒸氣的一個一個的h2o分子,必須加熱到500℃左右。其次,同樣由於分子被推壓在一起,比普通水中要緊密得多,所以聚水的密度是普通水的1。5倍。
然而,聚水的概念,至今尚未被普遍接受。許多化學家認為,所謂聚水實際上是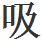 收了某些雜質的水,或者是溶解了一些玻璃的水。在這種情況下,那就
收了某些雜質的水,或者是溶解了一些玻璃的水。在這種情況下,那就 本不存在聚水了。
本不存在聚水了。